Titrasi asam basa adalah pembahasan materi kimia yang akan di jelaskan dibawah ini. Seringkali anda mendengar istilah titrasi, sebenarnya apakah titrasi itu? Metode untuk menentukan kadar suatu zat dengan menggunakan zat lain yang sudah diketahui konsentrasinya disebut titrasi.
Berdasarkan jenis reaksi dalam proses titrasi, maka titrasi dapat di bedakan menjadi:
1. Titrasi yang melibatkan reaksi asam basa, disebut titrasi asam basa.
2. Titrasi yang melibatkan pembentukan reaksi kompleks, disebut titrasi kompleksometri.
3. Titrasi yang melibatkan reaksi reduksi dan oksidasi disebut titrasi redoks.
Berdasarkan larutan baku yang di gunakan, titrasi dibagi menjadi 2 yakni sebagai berikut:
1. Asidimetri, penentuan konsentrasi larutan basa dengan menggunakan larutan baku asam.
2. Alkalimetri, penentuan konsentrasi larutan asam dengan menggunakan larutan baku basa.
Ada dua cara untuk menentukan titik ekuivalen (arti secara stoikiometri), yaitu ketika titran dan titer tepat habis bereaksi)
1. Dengan menggunakan pH meter
pH meter dapat digunakan untuk mengetahui perubahan pH selama titrasi di lakukan. Data pH dengan volume titrasi di gunakan untuk membuat kurva titrasi. Titik ekuivalen merupakan titik tengah dari kurva titrasi.
2. Indikator asam basa
Indikator di gunakan untuk mengetahui titik akhir titrasi (keadaan di mana titrasi di hentikan) yang di tandai dengan adanya perubahan warna. Indikator akan berubah warna ketika titik ekuivalen terjadi, lebih tepatnya saat titrasi di hentikan. Pada umumnya cara kedua lebih dipilih karena kemudahan dalam pengamatan, tidak di perlukan alat tambahan, dan sangat praktis, walaupun tidak seakurat dengan pH meter.
Menentukan Kadar Larutan yang Di Titrasi
Pada dasarnya reaksi dalam titrasi merupakan reaksi penetralan. Bahasan ini tentu sudah kita pelajari pada pembelajaran sebelumnya. Titrasi di hentikan tepat pada saat jumlah mol ion H+ setara dengan jumlah mol ion OH-. Pada saat itu larutan bersifat netral dan disebut titik ekuivalen. Bagaimana cara menetukan titik ekuivalen? Untuk mengamati titik ekuivalen dapat di gunakan indikator yang perubahan warnanya di sekitar titik ekuivalen. Saat terjadi perubahan warna itu di sebut titik akhir titrasi.
Pada saat titik ekuivalen maka mol ekuivalen asam akan sama dengan mol ekuivalen basa, maka hal ini dapat di tulis sebagai berikut:
mol ekuivalen asam = mol ekuivalen basa
Rumus umum titrasi pada saat titik ekuivalen sebagai berikut:
a . Ma . Va = b . Mb . Vb
Keterangan:
a = jumlah valensi ion H+
Ma = molaritas asam
Va = volume asam
b = jumlah valensi ion H+
Mb = molaritas basa
Vb = volume basa
Contoh :
50 mL larutan HCI di titrasi dengan larutan NaOH2 M. Berapakah konsentrasi larutan HCI, apabila larutan NaOH yang di butuhkan untuk mencapai titik ekuivalen sebanyak 25 mL?
Diketahui : a = 1 b = 1
Va = 50 mL Mb = 2 M
Vb = 25 mL
Ditanya : Ma = ...?
Jawab : a . Ma . Va = b . Mb . Vb
1 . Ma . 50 = 1 . 2 . 25
Ma = 1 M
Jadi, konsentrasi larutan HCI yang di titrasi adalah 1 M.
Langkah-langkah Titrasi Asam Basa
Langkah-langkah yang di gunakan untuk melakukan titrasi asam basa, yaitu sebagai berikut:
1. Siapkan larutan yang akan di tentukan molaritas nya. Pipet larutan tersebut ke dalam erlenmeyer dengan menggunakan pipet volume.
2. Pilih indikator berdasarkan trayek pH dan perubahan warna indikator untuk memudahkan pengamatan. Tambahkan beberapa tetes pada larutan.
3. Tambahkan zat penitrasi setetes demi setetes dengan selalu menggoyangkan erlenmeyer agar terjadi reaksi sempurna.
4. Sesekali, pinggiran erlenmeyer di bilas agar zat yang bereaksi tidak menempel di dinding erlenmeyer.
5. Ketika mendekati titik ekuivalen, penambahan zat penitrasi di lakukan dengan sangat hati-hati. Buka keran buret, peniter yang keluar jangan sampai menetes, tetapi di tempelkan pada dinding erlenmeyer kemudian bilas dan goyangkan. Ada baiknya titrasi di lakukan sebanyak dua atau tiga kali (duplo atau triplo). Yang di maksud zat penitrasi adalah zat yang di tambahkan ketika melakukan titrasi.
6. Hitung volume larutan peniter, lalu tentukan molaritas larutan titran.
Kurva Titrasi
Perubahan pH pada titrasi asam basa ada bermacam-macam dan dapat di buat grafik sesuai kekuatan asam basa yang di reaksikan, sebagai berikut:
1. Jika larutan asam di tetesi basa, maka pH larutan naik, sebaliknya jika larutan basa di tetesi asam maka pH larutan turun.
2. Grafik perubahan pH pada titrasi asam dengan basa (atau sebaliknya) di sebut kurva titrasi.
3. Macam perhitungan pH dalam titrasi, yaitu sebagai berikut:
a. Pada titik awal, sebelum titrasi di mulai.
b. Daerah antara, titrasi sudah di lakukan akan tetapi sebelum tercapai titik setara.
c. Titik setara (ekuivalen), pada saat larutan tepat habis bereaksi.
d. Di atas titik ekuivalensi, setelah titik akhir di lewati, penambahan larutan dari buret masih dilakukan.
Macam-macam kurva titrasi, sebagai berikut:
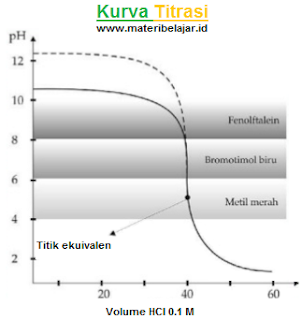
1. Titrasi asam kuat oleh basa kuat
Contoh: 40 mL larutan HCI 0,1 M di titrasi dengan larutan NaOH 0,1 M. Perhatikan kurva titrasi di bawah ini:
Dari kurva di atas terlihat bahwa titik ekuivalen terjadi pada penambahan NaOH sebanyak 40 mL dan pH = 7. Bagaimana dengan indikator asam basa yang di gunakan? Ketiga indikator asam basa yang tertulis pada kurva tersebut (fenolftalin, bromtimol biru, dan metil merah) bisa di gunakan untuk titrasi asam kuat oleh basa kuat. Indikator fenolftalin lebih di anjurkan karena memberikan perubahan warna yang jelas dari tidak berwarna menjadi merah muda (trayek pH = 8, 2-10, 0)
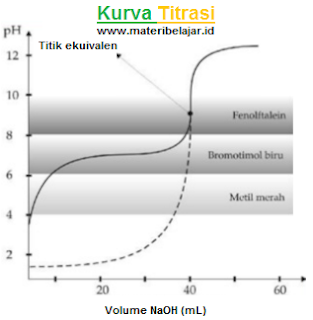
2. Titrasi basa kuat oleh asam kuat
Contoh: 40 mL larutan NaOH 0,1 M di titrasi dengan larutan HCI 0,1 M. Kurva titrasi nya di gambarkan sebagai berikut:
Seperti pada titrasi asam kuat oleh basa kuat, titik ekuivalen titrasi ini pada saat penambahan NaOH sebanyak 40 mL dan pH = 7. Ketiga indikator asam basa yang tertulis (fenolftalin, bromtimol biru dan metil merah) bisa di gunakan sebagai indikator dalam titrasi ini.
3. Titrasi asam lemah oleh basa kuat
Contoh: Sebanyak 50 mL asam lemah CH3COOH 0,1 M di titrasi dengan larutan basa kuat NaOH 0,1 M. Kurva titrasi yang terjadi di gambarkan sebagai berikut:
Dari kurva di atas terlihat bahwa titik ekuivalen titrasi lebih besar dari pada 7. Hal ini di sebabkan garam yang terbentuk mengalami hidrolisis sebagian yang bersifat basa (pH > 7). Indikator yang bisa di gunakan adalah bromtimol biru dan fenolftalin.
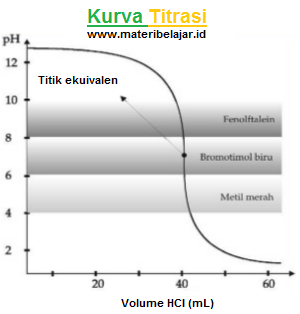
4. Titrasi basa lemah oleh asam kuat
Contoh: 50 mL NH3 0,1 M di titrasi dengan HCI 0,1 M, dapat di tunjukkan pada kurva di bawah ini yaitu sebagai berikut:
Dari kurva tersebut, terlihat bahwa titik ekuivalen terjadi pada pH < 7. Hal ini di sebabkan garam yang terbentuk mengalami hidrolisis sebagian yang bersifat asam (pH < 7). Adapun indikator asam basa yang bisa di gunakan sebagai indikator titrasi adalah metil merah dan bromtimol biru. Demikian pembahasan mengenai titrasi asam basa dalam ilmu kimia.